
IMAGEN – S. RAMÓN Y CAJAL, EL PRECURSOR…
Elaboran un mapa molecular detallado del camino que sigue una célula madre del cerebro adulto hasta convertirse en una neurona madura
En un artículo publicado en la revista Science Advances, investigadores de la Fundación Instituto Leloir y de la Universidad de Harvard (EE.UU.) establecieron el recorrido molecular que sigue una neurona nueva generada en el hipocampo del cerebro adulto hasta convertirse en una neurona madura. Para eso elaboraron un mapa con todos los genes involucrados en cada etapa. Este conocimiento es fundamental para el desarrollo de posibles estrategias contra enfermedades neurodegenerativas como el Alzheimer, condiciones fisiológicas como el envejecimiento, o lesiones cerebrales.
BUENOS AIRES – (Agencia CyTA-Leloir).- Si bien se sabe desde hace casi seis décadas que el hipocampo del cerebro adulto de muchos mamíferos genera nuevas neuronas a lo largo de toda la vida, se desconocían los genes involucrados en la maduración neuronal, el proceso que permite cumplir con las funciones requeridas para el funcionamiento de los circuitos cerebrales. Ahora, científicos de la Fundación Instituto Leloir (FIL), en Buenos Aires, y de la Universidad de Harvard, en Boston, Estados Unidos, revelaron en la revista Science Advances los mecanismos moleculares que participan en cada etapa, un conocimiento clave para posibles intervenciones contra enfermedades neurodegenerativas, condiciones fisiológicas como el envejecimiento o lesiones cerebrales.
“Identificamos y elaboramos un mapa detallado de los factores de transcripción –genes que regulan la expresión de otros genes– que se van prendiendo y apagando durante el proceso de maduración de una célula madre a una neurona madura en el giro dentado del hipocampo, que es una de las regiones donde se generan neuronas nuevas en el cerebro adulto ”, explicó a la Agencia CyTA-Leloir la doctora en Biología Damiana Giacomini, investigadora del CONICET en el Laboratorio de Plasticidad Neuronal de la FIL y una de las autoras principales del trabajo.
“Esto aporta un nuevo escenario porque el hipocampo es una de las zonas afectadas por enfermedades neurodegenerativas como el Alzheimer. Entonces, entender qué sucede en situaciones fisiológicas normales permitirá luego, a largo plazo, pensar cómo prevenir o minimizar situaciones patológicas”, añadió.
En la actualidad, diversos laboratorios en el mundo investigan sobre reprogramación neuronal, una técnica experimental que apunta a cambiar la identidad de una célula para convertirla en neurona como una manera de “reparar” o “suplir” el funcionamiento de otras que están alteradas. “Para eso, por ejemplo, es necesario saber qué factores de transcripción o genes le dan no sólo la identidad a una neurona sino también las características distintivas de cada etapa del desarrollo, que es lo que estamos aportando con este trabajo”, aseguró Giacomini.

(de izq. a der.) Ariel Chernomoretz, Ariel Berardino y Maximiliano Beckel, del Laboratorio de Biología de Sistemas Integrativa de la FIL.
(de izq. a der.) Damiana Giacomini, Alejandro Schinder y Natalí Rasetto, del Laboratorio de Plasticidad Neuronal de la FIL.
Durante muchos años, en el Laboratorio de Plasticidad Neuronal de la FIL, que dirige el doctor en Ciencias Biológicas Alejandro Schinder, se dedicaron a estudiar el desarrollo de neuronas que nacen en el cerebro adulto, lo que les permitió describir, entre otras cosas, cómo una neurona nueva se conecta con el circuito de un cerebro ya formado. “Nuestro laboratorio estableció que una neurona nueva del cerebro adulto necesita ocho semanas para completar su desarrollo e integrarse. Sin embargo, no sabíamos cuáles eran los genes responsables de los cambios que ocurren durante ese proceso”, señaló la biotecnóloga Natalí Rasetto, también autora del artículo. “Entonces nos propusimos estudiar los conjuntos de genes que guiaban el desarrollo de neuronas en el hipocampo de un cerebro adulto”, agregó.
Paso a paso
Todas las células de un organismo poseen los mismos genes. Sin embargo, para que cada una cumpla un rol determinado deben activarse (expresarse) un conjunto de genes particulares. En este proyecto, los investigadores estudiaron en ratones los genes de casi 40.000 neuronas de distintas edades. Para eso utilizaron una estrategia de datación precisa de nacimiento, que permitió seguir el desarrollo de las neuronas recién generadas por medio de la secuenciación de ARN de núcleo único (sn-RNAseq), una novedosa técnica que permite dilucidar la expresión de cada uno de los genes a lo largo de la vida de cada neurona individual.
Los científicos determinaron que, según los genes que se van expresando a lo largo de ocho semanas, las nuevas neuronas pasan por cuatro estados principales: células madre neurales quiescentes, células proliferativas, células granulares inmaduras postmitóticas y células granulares maduras.

(de izq. a der.) Damiana Giacomini, Alejandro Schinder y Natalí Rasetto, del Laboratorio de Plasticidad Neuronal de la FIL.
“Utilizamos neuronas de distintas edades, desde la semana 1 a la 8, a las que etiquetamos por medio de proteínas fluorescentes. Sabiendo la ‘edad’, y por medio de la secuenciación del ARN, pudimos evaluar el transcriptoma –los genes que se expresan– de neuronas particulares y compararlo con el de otras neuronas a lo largo del tiempo para ordenarlas según su parecido y, así, obtener una trayectoria de maduración neuronal”, describió Giacomini.
El trabajo fue dirigido por Alejandro Schinder y del mismo participaron, además, Ariel Berardino, Maximiliano Beckel y Ariel Chernomoretz, del Laboratorio de Biología de Sistemas Integrativa de la FIL, y Paola Arlotta y su equipo, del departamento de Células Madre y Biología Regenerativa de la Universidad de Harvard.
“A diferencia de estudios previos, que hacían foco en los primeros estadios del desarrollo neuronal en animales adultos, este trabajo describe por primera vez el programa genético completo de desarrollo de una neurona nacida en el cerebro adulto”, explicó Rasetto. Y concluyó: “Este trabajo constituye un atlas genético con una resolución temporal sin precedentes, que establece las bases moleculares que permitirán estudiar el proceso de neurogénesis adulta en distintas especies animales, incluyendo a los humanos”.
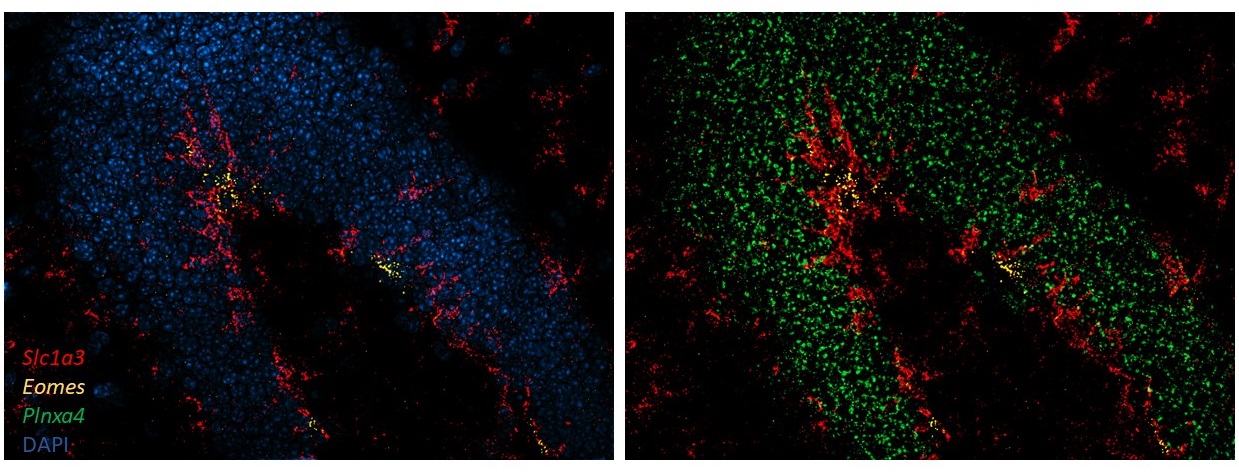
Imagen de microscopía del giro dentado del hipocampo. Los colores muestran la expresión de genes en los distintos estados celulares descriptos en el trabajo.
CYTA – LELOIR